Ácido acrílico
| Ácido acrílico | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ácido Prop-2-enoico | ||
| General | ||
| Otros nombres |
Ácido etilenocarboxílico Ácido propénico Ácido propenoico Ácido vinilcarboxilico | |
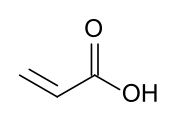
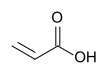
| Fórmula estructural |
 | |
| Fórmula molecular | C3H4O 2 | |
| Identificadores | ||
| Número CAS | 79-10-7[1] | |
| Número RTECS | AS4375000 | |
| ChEBI | 18308 | |
| ChEMBL | CHEMBL1213529 | |
| ChemSpider | 6333 | |
| DrugBank | DB02579 | |
| PubChem | 19966351 6581, 19966351 | |
| UNII | J94PBK7X8S | |
| KEGG | D03397 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 1051 kg/m³; 1,051 g/cm³ | |
| Masa molar | 72,06 g/mol | |
| Punto de fusión | 287 K (14 °C) | |
| Punto de ebullición | 414 K (141 °C) | |
| Viscosidad | 1,3 cP a 20 °C (293 K) | |
| Propiedades químicas | ||
| Acidez | 4,35 pKa | |
| Solubilidad en agua | Soluble. | |
| Peligrosidad | ||
| Frases R | R10, R20, R21, R22, R35, R50 | |
| Frases S | S26, S36, S37, S39, S45, S61 | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El ácido acrílico es un compuesto químico de fórmula CH2=CHCO2H (C3H4O2). Se trata del ácido carboxílico insaturado más simple, con un enlace doble y un grupo carboxilo que ocupa la posición C1. En su estado puro, se trata de un líquido corrosivo, incoloro y de olor penetrante. Es miscible con agua, alcoholes, éteres y cloroformo. Se produce a partir del propileno, un subproducto gaseoso de la refinación del petróleo.[2]
- CH2=CHCH3 + 1.5 O2 → CH2=CHCO2H + H2O
Debido al hecho de que el propano es una materia prima significativamente más barata comparada con el propileno, se estudia intensamente la oxidación selectiva en una etapa de propano a ácido acrílico.[3][4][5][6]
Presenta una acentuada tendencia a la creación de polímeros, los cuales se utilizan comercialmente en su forma neutralizada (como el poliacrilato de sodio).
Friedrich Konrad Beilstein obtuvo ácido acrílico mediante la destilación de ácidos hidroacrílicos en 1862.
Reactividad y usos
[editar]El ácido acrílico reacciona, como ácido carboxílico que es, con un alcohol, para formar la correspondiente sal o el correspondiente éster (conocidos como acrilatos o propenoatos). Los ésteres alquílicos más comunes del ácido acrílico son el etil-, butil- y metilacrilato (metacrilato).
El ácido acrílico y sus ésteres rápidamente se combinan con ellos mismos (para formar ácido poliacrílico) u otros monómeros (como acrilamida, acrilonitrilo, vinilo, estireno y butadieno) por reacción con sus dobles enlaces, formando homopolímeros o copolímeros que se usan en la fabricación de plásticos, adhesivos, pinturas, fibras y textiles, superabsorbent polymers (SAP), etc.
La demanda de ácido acrílico aumentó constantemente de 3,2 millones de toneladas (2005) a aprox. 5,57 millones de toneladas (2014).
Referencias
[editar]- ↑ Número CAS
- ↑ Takashi Ohara, Takahisa Sato, Noboru Shimizu, Günter Prescher Helmut Schwind, Otto Weiberg, Klaus Marten, Helmut Greim “Acrylic Acid and Derivatives” in Ullmann's Encyclopedia of Industrial Chemistry 2003, Wiley-VCH, Weinheim. doi 10.1002/14356007.a01_161.pub2 10.1002/14356007.a01_161.pub2
- ↑ «Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts». Tesis doctoral (en inglés). 2011. Consultado el 2016.
- ↑ «The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts». Journal of Catalysis 311: 369-385. de marzo de 2014. doi:10.1016/j.jcat.2013.12.008.
- ↑ «Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol». ACS Catalysis 3 (6): 1103-1113. 7 de junio de 2013. doi:10.1021/cs400010q. Consultado el 2016.
- ↑ «Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid». Journal of Catalysis 285 (1): 48-60. de enero de 2012. doi:10.1016/j.jcat.2011.09.012.
Enlaces externos
[editar]- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del ácido acrílico.
Véase también
[editar]
